癌细胞通常表现出大规模的基因组变异,其中包括出现染色体外环状DNA(ecDNA)和大尺度结构变异(SV),先前的报道已经指出这些变异与癌症的发生、发展和预后高度相关。近年来,越来越多的研究关注ecDNA在肿瘤中的作用。ecDNA是一种存在于染色体外的染色质元件,其中携带有癌基因和耐药基因。ecDNA具有高度扩增特性,可导致癌基因和耐药基因的表达升高,从而促进癌细胞的发育和进化。此外,ecDNA的不均匀的分离还能导致癌细胞的异质性,在应对肿瘤微环境中的选择压力时提供竞争优势。然而,近期的研究表明,ecDNA基因的高表达并不仅仅依赖于拷贝数的扩增,还涉及到更多的机制,比如显着增强的染色质可及性、共扩增增强子、相关基因组重塑以及与染色质的相互作用【1-4】。综上所述,ecDNA 在人类癌症中扮演着重要的角色。
泛癌症研究表明,基于二代测序分析,ecDNA可以在许多原发性癌症中被有效检测到。使用计算工具和从二代测序获得的全基因组测序数据检测 ecDNA 相当具有挑战性,因为需要对深度测序的短读长进行处理,从而使一次捕获多个断点变得极其困难。相较于全基因组测序,Circle-seq方法可以通过线性基因组DNA的消化和滚环扩增来实现对特定环形DNA的富集,从而减少了对测序深度的需求。然而,Circle-seq只能捕获ecDNA,丧失了其它的基因组变异信息。目前尚缺乏有效的技术检测单细胞水平的ecDNA等结构变异同时检测转录组,无法揭示ecDNA等结构变异对异质癌细胞群中基因表达的调节。
近日,广州医科大学联合生命科学学院/广州国家实验室范小英课题组在Clinical and Translational Medicine杂志上发表了题为Single cell third-generation sequencing-based multi-omics uncovers gene expression changes governed by ecDNA and structure variation in cancer cells的文章(原文链接:https://onlinelibrary.wiley.com/doi/10.1002/ctm2.1351)。

在这项研究中,研究团队开发了一种名为scGTP-seq的单细胞双组学技术(图1),可以同时获得单个细胞中基因组结构变异信息和转录组表达信息。借助这项技术,研究团队深入探究了多种癌症细胞系及临床癌症样品细胞中的ecDNA和结构变异对基因表达的影响,为我们深入理解ecDNA的种类及其在癌症中的作用等重要问题提供了新的思路和启示。
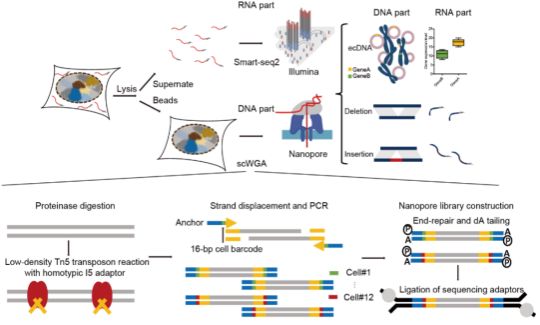
图1. scGTP-seq流程示意图
首先,研究团队在基于转座酶的单细胞全基因组扩增流程SMOOTH-seq【5】的基础上,通过物理分离细胞质和细胞核分别获得RNA和基因组DNA进行扩增,进一步优化转录组和基因组的扩增条件,获得了高质量的基因表达和基因组覆盖信息。为了针对TGS数据进行有效地ecDNA挖掘,研究团队开发了一套名为ecDNAFinder的生物信息流程(图2),并通过多种质粒定量的spike-in实验和DNA FISH技术验证了scGTP-seq对ecDNA捕获的有效性及准确性。
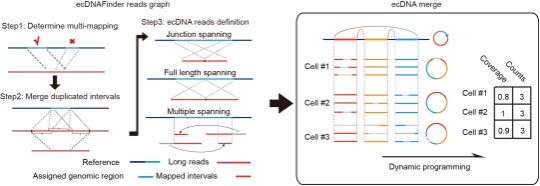
图2. ecDNAFinder的设计流程
接下来,研究团队用scGTP-seq对3种不同的癌细胞系进行了探究,发现ecDNA表现出细胞类型特异性。ecDNA主要存在于癌细胞中,但不同的癌细胞类型中具有不同的ecDNA种类和数量,同一ecDNA在不同细胞类型中的拷贝数也不同(图3)。GO富集分析显示这些ecDNA基因具有与癌症相关功能。尽管 ecDNA 基因总体上表现出较高的表达水平,但这种表达水平的变化并不完全依赖于 ecDNA 拷贝数,这表明ecDNA的拷贝数并非决定ecDNA基因的唯一机制。研究团队还利用scGTP-seq进行了SV的检测和验证,进一步鉴定出一些产生相应变异转录本的删除和插入事件,为SV的功能研究提供了有力的支持。
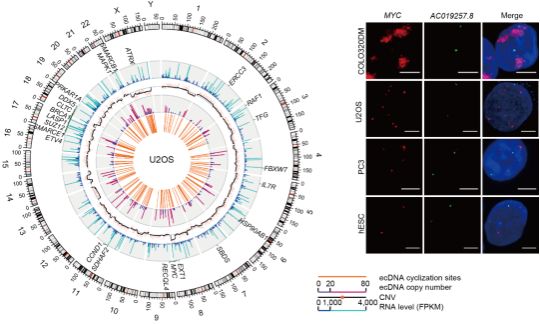
图3. U2OS细胞的ecDNA、结构变异及基因表达信息(左)以及DNA Fish显示MYC ecDNA在不同肿瘤细胞中丰度存在差异(右)
最后,为了验证scGTP-seq对于临床样本具有应用价值,研究团队对肝癌临床样本进行了分析,有效捕捉到了肿瘤细胞中的ecDNA。令人惊讶的是,ecDNA不仅存在于肿瘤细胞中,肿瘤相关的内皮细胞和巨噬细胞中也检测到了ecDNA存在。
综上所述,本研究提供了一种单细胞分辨率下准确测量大尺度基因组变异及其对下游转录水平影响的测序技术及算法,证明SV与ecDNA可以从结构和数量上明显改变基因的结构和表达水平。同时,本研究还提供了人类癌症中ecDNA多样性的证据,在异质性较高的肿瘤组织细胞中也取得了良好的表现。相关探索还表明了ecDNA中癌基因的富集与高表达,进一步提出了将ecDNA作为癌症研究靶点的可能性。
广州医科大学生命科学学院/广州国家实验室范小英研究员为本文的通讯作者,常蕾副研究员与实习研究员邓恩泽、王俊和周伟为本文的共同第一作者。本项研究得到国家自然基金委项目的支持。
参考文献
1. Zhu, Y., Gujar, A.D., Wong, C.-H., Tjong, H., Ngan, C.Y., Gong, L., Chen, Y.-A., Kim, H., Liu, J., Li, M., et al. (2021b). Oncogenic extrachromosomal DNA functions as mobile enhancers to globally amplify chromosomal transcription. Cancer Cell 39, 694-707.e697.
2. Koche, R.P., Rodriguez-Fos, E., Helmsauer, K., Burkert, M., MacArthur, I.C., Maag, J., Chamorro, R., Munoz-Perez, N., Puiggròs, M., Garcia, H.D., et al. (2020). Extrachromosomal circular DNA drives oncogenic genome remodeling in neuroblastoma. Nat. Genet. 52, 29-34.
3. Morton, A.R., Dogan-Artun, N., Faber, Z.J., MacLeod, G., Bartels, C.F., Piazza, M.S., Allan, K.C., Mack, S.C., Wang, X., Gimple, R.C., et al. (2019). Functional Enhancers Shape Extrachromosomal Oncogene Amplifications. Cell 179, 1330.
4. Wu, S., Turner, K.M., Nguyen, N., Raviram, R., Erb, M., Santini, J., Luebeck, J., Rajkumar, U., Diao, Y., Li, B., et al. (2019). Circular ecDNA promotes accessible chromatin and high oncogene expression. Nature 575, 699-703.
5. Fan, X., Yang, C., Li, W., Bai, X., Zhou, X., Xie, H., Wen, L., and Tang, F. (2021). SMOOTH-seq: single-cell genome sequencing of human cells on a third-generation sequencing platform. Genome Biol. 22, 195-195.