胶质母细胞瘤(GBM)是最凶险的原发性脑肿瘤类型。近年来,尽管免疫疗法在多种癌症中取得了显著突破,但GBM患者的响应却非常有限,开发针对GBM的新治疗策略迫在眉睫。其中重要的原因可能是GBM特有的免疫抑制微环境包含了大量的肿瘤相关巨噬细胞(TAMs)1。尽管有研究显示调控TAMs的策略可以增强抗肿瘤免疫应答,但这些策略在临床试验中并未取得令人满意的结果,这可能是现有的TAMs靶点不够理想2。因此,科学家们仍在努力寻找新的基于TAMs调控的治疗策略及理想的新靶点。
2023年7月17日,贾广帅/冷启彬团队在Nature Cancer发表题为Siglec-9 acts as an immune checkpoint molecule on macrophages in glioblastoma, restricting T cell priming and immunotherapy response的研究成果,发现了一种被称为Siglec-9的分子,它在GBM中充当巨噬细胞表面的免疫检查点分子,对肿瘤内免疫环境和免疫治疗效果有显著影响。

研究团队通过对接受了抗PD-1抗体新辅助治疗的GBM患者样本进行单细胞RNA测序和空间转录组分析,发现在抗PD-1治疗无效的患者中,TAMs以高表达Siglec-9基因的肿瘤相关巨噬细胞(TAMs)居多。尽管抗PD-1治疗能够在一些GBM患者中改变肿瘤免疫环境,增加某些化学因子基因和干扰素-γ相关基因的表达,诱导前体样耗竭T细胞的产生,并激活传统树突状细胞,但这并不能改变瘤内免疫环境的整体抑制状态,特别是无法抵消Siglec-9高表达的巨噬细胞(Siglec-9+ TAMs)的免疫抑制功能。研究团队进一步发现,Siglec-9+ TAMs可以区分为连续分化的Siglec-9+MARCO+ TAMs和Siglec-9+SEPP1+ TAMs。空间转录组分析显示,这两类TAMs是由CD14+ 单核细胞以分步方式迁移到肿瘤中并分化而来的,Siglec-9+MARCO+ TAMs可能代表了循环中的单核细胞分化为Siglec-9+SEPP1+ TAMs的过渡状态。
Siglec-9分子属于免疫球蛋白样凝集素(Siglec)家族成员,是表达于巨噬细胞等髓系免疫细胞表面的受体。这些受体与含有唾液酸残基的宿主/癌细胞膜上的糖蛋白结合时,能作为免疫检查点分子传递免疫抑制信号3。通过基因敲除小鼠颅内肿瘤模型的研究,研究团队发现,SiglecE(人Siglec-9的鼠功能同源基因)的敲除可以抑制GBM肿瘤的生长,改变巨噬细胞的免疫抑制表型,使其转变为更具有抗肿瘤活性的表型,并且显著增强T细胞的活化和增殖。进一步,研究者通过多种小鼠体内、体外实验和人临床样本验证,证明Siglec-9+/SiglecE+ TAMs是SiglecE敲除小鼠中抑制肿瘤生长的主要细胞群体,并且该亚群直接和T细胞相互作用,靶向Siglec-9是通过T细胞活化发挥肿瘤杀伤作用的。为了进一步明确靶向Siglec-9的临床前景,研究团队发现,SiglecE敲除小鼠接受抗PD-1治疗时,生存时间可以进一步延长。研究团队对小鼠GBM模型使用具有靶向Siglec-9功能的竞争性蛋白治疗,结果发现这种治疗可以显著延长小鼠的生存时间。
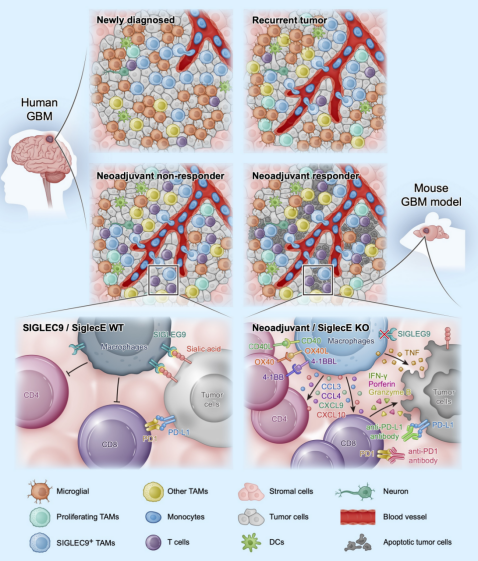
图1.人GBM和小鼠模型中的巨噬细胞特化及T细胞相互作用示意图
这项研究的发现为胶质母细胞瘤的治疗提供了新的思路,即 Siglec-9是一种新颖的巨噬细胞免疫检查点分子,可以作为靶点以提高针对GBM治疗的抗PD-1/PD-L1疗效。这一研究还显示,将人类临床样本的单细胞分析与小鼠转化研究相结合,可以有效地发现基于新型免疫检查点和新免疫细胞亚群的免疫疗法(图1)。
广州医科大学贾广帅和冷启彬是本文的共同通讯作者。合作团队还包括中山大学中山医学院陈俊团队及广东省人民医院病理科张庆玲团队。本项研究得到国家自然基金委项目和学校双一流建设——生物学学科建设项目的支持。
原文链接:
https://www.nature.com/articles/s43018-023-00598-9